近日,中科院合肥研究院强磁场中心王俊峰研究员课题组与3家国外团队(黄韵教授,韩纲教授和周育斌教授课题组)合作,基于燕麦蓝光受体蛋白LOV2进行了优化循环排列(Circular permutation)设计,获得了能够提供不同锁定界面的光控开关元件蛋白cpLOV2,进一步拓展了LOV2系列蛋白在光遗传学工程中的应用。该团队利用cpLOV2实现了钙离子通道的远程开启,CRISPR–Cas9介导的基因编辑控制,基因转录的光控重编程,癌细胞自杀的激活以及光控细胞免疫疗法来诱导肿瘤细胞体内杀伤。该工作以“Circularly permuted LOV2 as a modular photoswitch for optogenetic engineering”为题在线发表于化学生物学领域顶级科技期刊Nature Chemical Biology。
LOV2是一种光控开关蛋白,受到蓝光激发后蛋白质C端Jα螺旋会发生解旋并与感光核心PAS结构域分离。研究者们将具有生命活动调控功能的不同蛋白质效应子(Effector)连接到LOV2的C端,利用其在黑暗下被锁定失活、光照下被释放激活的特点,来实现光遗传学对生命活动的控制。然而,效应子通常只能连接到LOV2蛋白的C端,其与光控元件相互作用锁定界面相对有限,使得整个开发过程成功率不高。因此拓展光控开关元件的选择性有助于更快、更有效地构建新型光遗传学工具。
在本研究中,研究团队对LOV2进行了优化循环排列(Circular permutation)设计构建了cpLOV2,在保持PAS结构域不变前提下,将蛋白质的N、C两个末端转移到Jα螺旋的另一端,使得光照释放Jα螺旋的过程发生在蛋白的N端,从而拓展了效应子的可用连接方式。在体外实验中,研究团队利用液体核磁共振等技术证明了cpLOV2具有与LOV2相似的整体结构,和光激发后Jα螺旋解旋并释放的能力,并在LOVTRAP和iLID两种光控蛋白二聚体系中实现了无缝转化。
cpLOV2为光遗传学应用的开发提供了更多可能性。例如在STIM1介导的光控ORAI钙离子通道开放的应用中,研究团队尝试了多种不同的基于LOV2和cpLOV2构建方式,结合STIM1效应子SOAR、自抑制区域CC1等不同序列,新发现了几种仅在cpLOV2构建方式下可以实现较强的光控通道激活效应的组合,从而证明了cpLOV2与效应子的作用界面和方式与LOV2有显著的区别。cpLOV2对于需要自由N端的效应子,例如细胞程序性坏死(Necroptosis)的关键因子MLKL,cpLOV2-MLKL有效地实现了光控的细胞死亡(LOV2-MLKL无法实现)。
嵌合抗原受体T细胞(CAR-T)免疫疗法是一种治疗癌症的新方法,但是由于CAR-T细胞治疗时活性不可调控,部分癌症患者会产生细胞因子释放综合征(cytokine release syndrome)等严重副作用。研究团队设计了基于cpLOV2的光控二聚体系(cpLID),以此为基础构建了光敏嵌合抗原受体optoCAR。光响应的optoCAR-T细胞可以特异性识别CD19肿瘤抗原,导致T细胞活化、增殖并且行使对Raji淋巴瘤细胞的杀伤。
在小鼠实验中,研究团队利用上转换纳米颗粒(UCNPs)将机体高穿透性的红外光转换成蓝光来激活注入小鼠体内的optoCAR-T细胞,从而在动物模型上实现了针对淋巴瘤的高效光控治疗。optoCAR-T疗法较好的时间空间控制和可逆激活的能力,使得治疗的脱靶效应毒性大大减小,在不损失肿瘤杀伤效果的同时,有望减少副作用的产生。
研究团队计划将进一步尝试开发针对多种癌症的光控optoCAR-T免疫疗法。
中科院合肥物质科学研究院强磁场科学中心朱磊博士,以及合作团队的何涟博士、谭鹏博士和黄凯是该文的共同第一作者,王俊峰研究员为该文的共同通讯作者。
文章链接:https://dx.doi.org/10.1038/s41589-021-00792-9
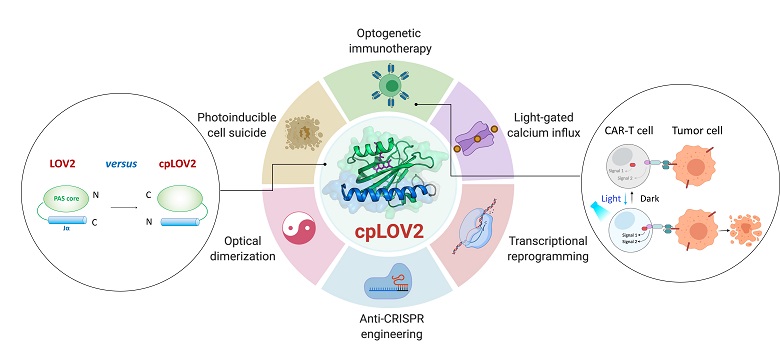
cpLOV2改造设计及其光遗传学应用拓展
新闻链接:http://www.hf.cas.cn/xwzx/tpxw/202105/t20210508_6010688.html